Revista
Industrial Data 22(1): 187-202 (2019)
ISSN: 1560-9146 (Impreso) / ISSN: 1810-9993 (Electrónico)Hugo RomeRo / CintHia maCías / aRaCelly PalaCios / FeliPe RedRovan
DOI: http://dx.doi.org/10.15381/idata.v22i1.16534
Facultad de Ingeniería Industrial -
UNMSM
Estudio
cinético de la producción de bioetanol a partir de residuos agroindustriales de
la cáscara de banano maduro
Hugo Romero Bonilla [1]
Cinthia Macías Balón [2]
Aracelly Palacios Moreno [3]
Felipe
Redrovan Pesantez [4]
Recibido: 15/01/2018 AceptAdo: 08/02/2019
|
RESUMEN
Esta
investigación aborda la aplicación de un compuesto de polietilenglicol (PEG)
de masa molecular 1500, cuyo objetivo es degradar los compuestos inhibidores
presentes durante la hidrólisis enzimática de la cáscara de banano maduro de
la variedad Cavendish. Asimismo, se realizaron tres experimentos al 60% de cáscara
de banano molida, en los que se adicionó PEG a diferentes concentraciones:
0,01; 0,02; 0,03 g/g biomasa. La hidrólisis enzimática se realizó con
conidios del hongo Trichoderma viride
y su posterior fermentación alcohólica fue con levadura activa seca comercial
de Saccharomyces cerevisiae, que
previamente fue activada. El mejor resultado corresponde al experimento PEG3
(0,03 g/g biomasa), con el que se obtuvo un mayor incremento de azúcares
reductores. Además, se encontraron diferencias significativas (p<0,5) para
la glucosa obtenida entre los tres tratamientos hidrolíticos. Los resultados
demuestran que, a partir de los residuos lignocelulósicos de la cáscara de
banano maduro, se puede obtener bioetanol, cuyo rendimiento obtenido de 7%
v/v se aproxima a otros reportados en el mismo campo de estudio. Finalmente,
el análisis de los costos variables del pretratamiento, aplicado a la cáscara
de banano en la producción de etanol obtenido, permite estimar que el método
planteado en este artículo es menos costoso comparado con los demás
procedimientos, demuestra un mayor rendimiento de bioetanol y se obtiene en
menor tiempo.
|
Palabras-claves: Cáscara de banano; polietilenglicol; hidrólisis enzimática;
fermentación alcohólica; bioetanol.
INTRODUCCIÓN
Las crecientes demandas de
combustible derivado del petróleo, debido al rápido desarrollo de la industria
automotriz, junto con los problemas de contaminación ambiental, han inspirado
los esfuerzos en la exploración de combustibles alternativos (Thangavelu, Saleh y Nasir, 2016). Desde esta perspectiva, se ha
fomentado la producción y el consumo de energías renovables, sostenibles y
respetuosas con el medioambiente, a través de la biomasa lignocelulósica, la
cual puede obtenerse a partir de materiales de desecho de las actividades
agrícolas (Conesa, Segui y Fito, 2013). Las fuentes de biocombustibles están
distribuidas geográficamente de manera más uniforme que los combustibles
fósiles, lo que las convierte en una opción ideal para cumplir con los
requerimientos de manera sostenible. Varios promotores de esta alternativa
energética subyacen a los crecientes intereses de los biocombustibles, a causa
de la creciente incertidumbre de los suministros de petróleo por el aumento de
la demanda, la disminución de las reservas conocidas, la preocupación por el
calentamiento global y las emisiones de gases de efecto invernadero asociadas
con el uso de combustibles fósiles (Saini, Saini y Tewari, 2015).
Los sustratos vegetales están compuestos
por celulosa, hemicelulosa y lignina, los cuales eran considerados la materia
prima del futuro para la producción de biocombustibles, por su bajo costo y
disponibilidad (Abril y Navarro, 2012). La producción y el uso de dichos
combustibles ayudan a minimizar las emisiones de gases de efecto invernadero,
ya que son obtenidos de fuentes de energía alternativa; asimismo, la producción
de bioetanol a partir de materia lignocelulósica implica diferentes etapas:
pretratamiento, hidrólisis, fermentación (Silva y Oliveira, 2014).
Por esos
motivos, en este estudio se utilizará la cáscara de plátano, la cual es una
fuente abundante de material celulósico, que es el constituyente externo del
banano, representa alrededor del 40% en peso y tiene el potencial de producir
alcohol; sin embargo, es necesario un procesamiento químico y bioquímico para
convertir estos polímeros en azúcares monoméricos (Quintero, Martínez, Velasco
et al., 2015). Una vez en forma
monomérica, los azúcares pueden convertirse mediante microorganismos
fermentativos en bioetanol; además, durante la etapa de pretratamiento e
hidrólisis, se producen compuestos no deseables que afectan negativamente la
tasa de fermentación de la levadura. También, la toxicidad de estos compuestos,
llamados inhibidores, sobre los microorganismos es uno de los principales
factores limitantes en el rendimiento de bioetanol durante la fermentación
(Jaramillo, Gómez y Fontalvo, 2012). Por ello, debe realizarse un
pretratamiento antes de la hidrólisis para remover la lignina, hidrolizar la
hemicelulosa a azúcares fermentables, y reducir la cristalinidad de la celulosa
para liberar la glucosa (Morales, 2012). Esto determina el rendimiento que se
obtendría después de la fermentación alcohólica.
En ese sentido, Saval (2012) manifiesta que la
hidrólisis enzimática se aplica una vez que los residuos han sido tratados.
Así, las cadenas poliméricas son más expuestas para que la generación de
compuestos tóxicos no aumente y se evite la adición de compuestos químicos. El proceso se lleva a cabo mediante
la adición de enzimas celulíticas al biorreactor (Zhao, Cao, Wang et al., 2013). El uso de la Trichoderma en la industria
biotecnológica se debe a su capacidad de producir diversos metabolitos y por su
adaptación a diversas condiciones ambientales y sustratos. Por otro lado, la
levadura Saccharomyces cerevisiae es
usada frecuentemente en la fermentación alcohólica (Sotelo, Avilez y
Ginés-Carbajal, 2015), por ser un microorganismo anaeróbico
facultativo que tiene la capacidad de fermentar la glucosa y no presentar
muchas exigencias en cuanto a nutrientes. Por tal motivo, el objetivo de la
presente investigación fue hidrolizar la celulosa y hemicelulosa presente en la
cáscara de banano maduro a azúcares reductores y su posterior fermentación
alcohólica para obtener bioetanol de segunda generación.
METODOLOGÍA
Materiales
Las cáscaras utilizadas fueron de bananos
maduros de la variedad Cavendish. Estas habían sido desechadas de las líneas de
producción de la empresa Diana Food S. A., que tiene su planta de procesamiento
ubicada en Pasaje, provincia de El Oro, en Ecuador. Asimismo, se empleó
polietilenglicol de peso molecular 1500 (PEG 1500) de Sigma-Aldrich (Alemania).
El hongo fue obtenido de la marca comercial Trichoeb, proporcionado por Ecua
Biológica (Ecuador); y la levadura activa seca fue proporcionada por Levapan
(Ecuador).
Pretratamientos
Se molió la cáscara, con la finalidad de
aumentar su área de contacto con el hongo, luego se procedió a realizar un
tratamiento térmico en una autoclave All American 25X a 121 °C durante 15
minutos.
Diseño del experimento
Se prepararon tres soluciones al 60% de cáscara molida de banano,
concentración reportada por Romero,
Ayala, y Lapo (2015), ya que, con este porcentaje de cáscara se obtiene mayor
concentración de glucosa
hidrolizada. Se añadieron 3 concentraciones diferentes de PEG 1500, mostradas
en la Tabla 1: PEG1 (0,01); PEG2 (0,02) y PEG3 (0,03 g/g biomasa), para evaluar
su efecto como inhibidor en la hidrólisis, ya que la lignina y otros compuestos
que se encuentran presentes en los residuos lignocelulósicos limitan la
hidrólisis de la celulosa y la hemicelulosa (Ko, Um, Park et al., 2015).
Tabla 1. Factores y
niveles del experimento.
|
Adsorbentes
|
Concentración
PEG (g PEG/g biomasa)
|
|
|
|
|
|
|
[ ]1
|
[ ]2
|
[ ] 3
|
|
PEG 1500
|
0,01
|
0,02
|
0 , 03
|
[ ]1:
Concentración 1; [ ]2: Concentración 2; [ ]3: Concentración 3 Fuente: Elaboración propia.
Hidrólisis enzimática
La
hidrólisis enzimática de la biomasa se realizó en biorreactores de 2 L a una concentración
de 60% de cáscara, a los cuales se les añadió tres concentraciones diferentes
de PEG 1500 (0,01-0,03 g PEG/g biomasa). Estas habían sido disueltas en agua
purificada y agitadas durante 5 minutos para que el PEG absorba a los
inhibidores de la hidrólisis enzimática. Posteriormente, se adicionó 0,4 g/L de
conidios del hongo Trichoderma viride.
Se agitó durante 1 hora a 200 rpm y se tomó una muestra cada hora. Durante el
proceso se midió pH, °Bx (grados Brix) y oxígeno disuelto, para lo cual se utilizó
un medidor portátil de acuerdo a lo manifestado por Tejeda, López, Rojas et al. (2015).
Cuantificación de azúcares reductores
Para la cuantificación de glucosa se tomó una
muestra de hidrolizado en un tubo de ensayo y se centrifugó a 10 000 rpm durante
10 min, y con el sobrenadante se hizo una dilución de 1:10. Luego se tomaron
0,5 mL de la dilución y 0,5 mL del reactivo DNS, los cuales se colocaron en un
tubo de ensayo en baño de agua a 100 °C por 5 min. En este lapso el ácido 3,5
dinitrosalicílico fue reducido por los azúcares reductores que entran en
contacto con el mismo, ocasionando un cambio de color con variaciones de
amarillo hasta café (Ávila, Rivas, Hernández et al., 2012). Se enfrió hasta lograr temperatura de ambiente y se
adicionó 5 mL de agua destilada. Se agitó y se realizó la lectura a 540 nm en
el espectrofotómetro Hach DR 3900 (Canseco, Aráoz, Gusils et al., 2015).
Con el experimento PEG3 (PEG 0,03 g/g cáscara),
que fue el tratamiento con el que se obtuvo mayor concentración de glucosa, se
realizó la fermentación para la obtención de bioetanol.
Fermentación
Después de
la hidrólisis enzimática de la cáscara, se inactivó el hongo pasteurizando el
hidrolizado a 90 °C por 10 min (Centeno, 2016). Se trabajó con un volumen de
1000 mL, se controló el pH y se adicionó 800 ufc/mL de levadura seca comercial
(Saccharomyces cerevisiae) que
previamente fue activada; asimismo, se colocó el jarabe glucosado en un
biorreactor anaerobio, donde se tomaron muestras para medir la concentración de
alcohol mediante cromatografía de gases. El pH, °Bx y oxígeno disuelto se
midieron con un equipo multiparamétrico.
Estimación comparativa de
costos variables
Se realizó una estimación comparativa de costos
variables del proceso de sacarificación mediante hidrólisis enzimática y de
fermentación alcohólica, para lo cual se asumió una base de cálculo de 600 g de
cáscara/L de solución.
A continuación, en la Tabla 2 se detallan los
costos de los insumos necesarios en el proceso.
Tabla 2. Costo
estimado de los insumos necesarios para el proceso de sacarificación mediante
hidrólisis enzimática y fermentación alcohólica a partir de cáscara de banano
maduro.
|
Variable dependiente: costo
|
|
Insumos
|
Costo
|
|
Trichoderma (inóculo para hidrólisis en este estudio)
|
$ 0,05 para 600 g de
cáscara
|
|
Polietilenglicol (proceso
propuesto en este estudio)
|
$ 2,52 para 600 g de
cáscara
|
|
Vapor para la pasteurizacón
(proceso propuesto en este estudio)
|
$ 0,25 cada kg de vapor de
agua
|
|
Etanol para la desinfección
de la cáscara (proceso propuesto en la literatura)
|
$ 0,70 para 600 g de
cáscara
|
|
Asperguillus (inóculo para hidrólisis propuesto en la
literatura)
|
$ 0,01 para 600 g de
cáscara
|
|
Saccharomyces
|
$ 12,00 los 600 g
|
|
Cáscara de banano y
transporte
|
$ 0,072
|
Fuente:
Elaboración propia.
RESULTADOS
La Figura 1 presenta la producción de azúcares
reductores (mg/L) para los 3 tratamientos y una muestra control durante 24
horas de hidrólisis enzimática.
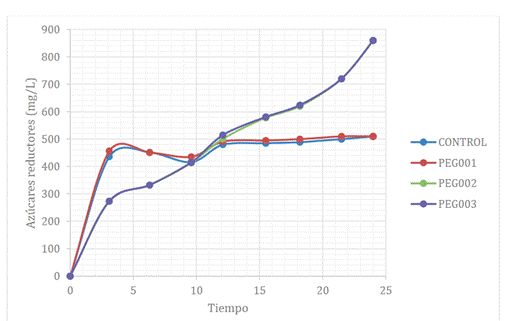
Figura 1. Cinética de la hidrólisis enzimática
para los tratamientos durante 24 horas
En el experimento con PEG 0,03 g/g biomasa se
alcanzó un incremento de 895,95 (± 1,9) mg/L de azúcares reductores, existiendo
diferencias significativas con respecto a los otros tratamientos, tal como se puede
evidenciar en la Tabla 3, donde todos los p-value alcanzaron valores menores a
0,05.
|
Tabla 3. Análisis de varianza para producción de glucosa en función de los
pretratamientos aplicados a cáscara de banano maduro.
|
Variable dependiente: glucosa
|
|
|
|
Origen
|
Tipo III de suma de cuadrados
|
gl
|
Media cuadrática
|
F
|
Sig.
|
|
Modelo
corregido
|
1 295
110,438a
|
31
|
41
777,756
|
2413,156
|
0,000
|
|
Intersección
|
18 604
125,563
|
1
|
18 604
125,563
|
1 074
606,531
|
0,000
|
|
Tiempo
|
788
371,938
|
7
|
112
624,563
|
6505,390
|
0,000
|
|
PEGC
|
99 025,312
|
3
|
33
008,437
|
1906,625
|
0,000
|
|
Tiempo *
PEGC
|
407
713,187
|
21
|
19 414,914
|
1121,439
|
0,000
|
|
Error
|
554,000
|
32
|
17,313
|
|
|
|
Total
|
19 899
790,000
|
64
|
|
|
|
|
Total
corregido
|
1 295
664,438
|
63
|
|
|
|
|
a. R al
cuadrado = 1000 (R al cuadrado ajustada = 0,999)
|
|
|
Fuente:
Elaboración propia.
|
Por otro lado, la Figura 2 muestra el efecto
del polietilenglicol (PEG) agregado a la cáscara de banano maduro molida a
diferentes concentraciones (Tabla 1), en la producción de glucosa. Se puede observar
que existen diferencias significativas entre los pretratamientos estudiados.
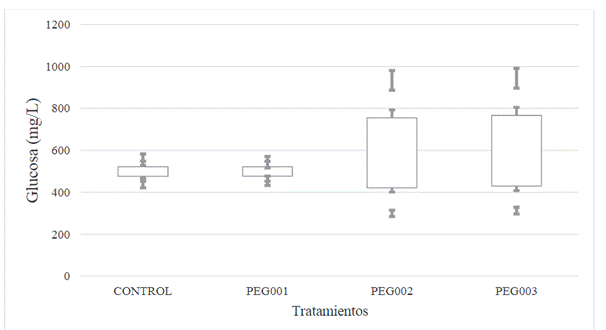
Figura 2. Medias de la evolución de glucosa
en función de los pretratamientos aplicados a la cáscara de banano maduro (95%
de confianza).
Fuente: Elaboración propia.
Por su parte, la variación del pH respecto al
tiempo de hidrólisis enzimática de cáscara de banano maduro en las condiciones
de estudio se puede observar en la Figura 3.
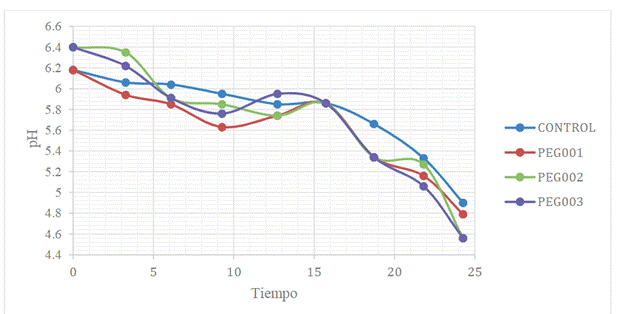
Figura 3. Variación del pH respecto al
tiempo para la hidrólisis a una escala de 2 L.
Fuente: Elaboración propia
Asimismo, la disminución del oxígeno
disuelto durante el proceso de hidrolizado, se muestra en la Figura 4.
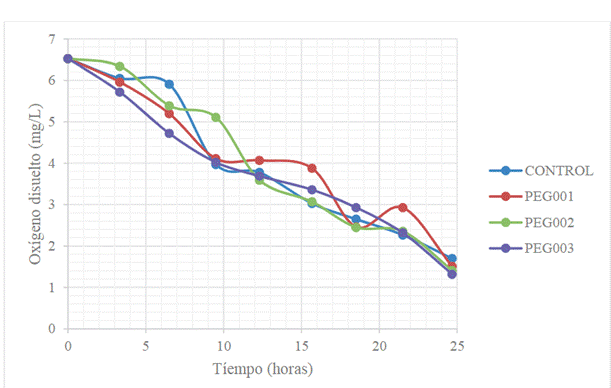
Figura 4. Disminución del oxígeno disuelto
para la hidrólisis enzimática a escala de 2 L.
Fuente: Elaboración propia.
Adicionalmente, el comportamiento de
la producción de bioetanol durante la fermentación por un periodo de 4 días se
observa en la Figura 5.
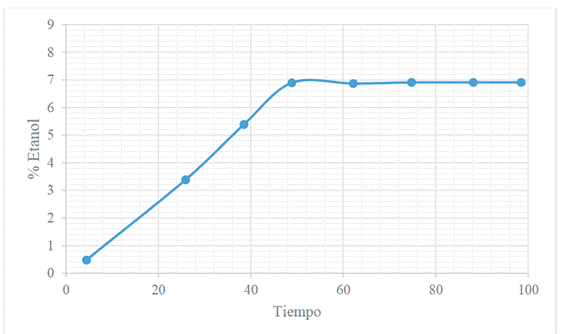
Figura 5. Cinética de la producción de bioetanol durante la fermentación
alcohólica.
Fuente: Elaboración propia
DISCUSIÓN
A partir de la Figura 1 se pudo
observar que la adición de PEG con concentración de 0,02 y 0,03 g/g biomasa
(PEG2 y PEG3) aumenta los rendimientos de azúcares reductores hasta valores de 895,95
(± 1,9) mg/L, lo que permitió obtener un rendimiento de alcohol del 7% v/v
(Figura 5). Este rendimiento de etanol obtenido en este estudio es mayor al
reportado por Benjamin, Singh, Dipuraj et al.
(2014), los cuales encontraron 2,38% y 6% de etanol a los 2 y 7 días
respectivamente. Estos autores utilizaron 5% de cáscara en polvo, Aspergillus niger al 3% p/v y pH 6,
desinfectada la cáscara de banano con etanol al 70%. Posteriormente, la secaron
al sol durante 7 días y la fermentaron con 4% v/v de inóculo de Saccharomyces cerevisiae. Un estudio
comparativo de costos variables se puede observar en la Tabla 3. Mayores
rendimientos de etanol (59,3% p/v) han sido reportados por Boluda, García,
González et al. (2010) a partir de
cáscara de mandarina, pero utilizando explosión con vapor como pretratamiento
de la biomasa utilizada en la fermentación alcohólica. Precisamente, este
pretratamiento tiene la desventaja de causar la generación de inhibidores que
afectan el proceso de fermentación, para lo cual debe combinarse con H2SO4 o CO2 para
mejorar la eficiencia del proceso; además, existe el riesgo de producción de
compuestos fenólicos solubles (Sánchez, Gutiérrez, Muñoz et al., 2010).
Por otra parte, con respecto al descenso del pH
en función del tiempo de hidrólisis de la cáscara de banano maduro presente en
los tratamientos PEG1, PEG2 y PEG3 (Figura 3), se puede manifestar que este se
produce desde 6,2 a 4,9 unidades de pH en el tratamiento de control; de 6,2 a
4,8 en el tratamiento PEG1; de 6,5 a 4,6 en el tratamiento PEG2; y de 6,5 a 4,6
en el tratamiento PEG3; estabilizándose después de 18 horas de hidrólisis en
todos los tratamientos, lo cual indica que el hongo modifica el pH del medio de
cultivo para su crecimiento y producción de glucosa.
Por su parte, el comportamiento del oxígeno
disuelto, respecto al tiempo (Figura 4), se puede observar que decrece conforme
avanza la hidrólisis enzimática, debido a que una fracción de este
microorganismo lo consume como parte de la vía metabólica aeróbica.
Además, el análisis en los costos
variables del pretratamiento aplicado a la cáscara de banano en la producción
de etanol obtenido en este estudio, para glucosa producida a partir del mejor
tratamiento aplicado (PEG3) en comparación con otros estudios, se presenta en
la Tabla 4 lo siguiente.
Tabla 4. Comparación de costos variables en
dólares para el proceso de obtención de etanol a partir de la hidrólisis
enzimática de cáscara de banano maduro (600 g).
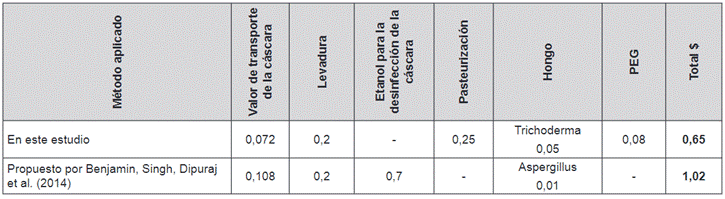
Fuente: Elaboración propia.
Estos costos están calculados en dólares para
cada etapa del proceso empleado, tanto en la hidrólisis enzimática como en la
fermentación alcohólica, utilizando una base de cálculo de 600 g de cáscara de
banano maduro (60% p/v).
Es importante mencionar que el método
mencionado por Benjamin, Singh, Dipurak et al. (2014) incluye una etapa de secado de la cáscara de banano por un
tiempo de 7 días, lo cual es una desventaja importante para el proceso
propuesto por esos autores.
CONCLUSIONES
Se observó que el polietilenglicol (PEG)
influye en la conversión de la celulosa de la cáscara de banano maduro en
glucosa mediante hidrólisis enzimática. Siendo el tratamiento PEG3, el que
produjo mayor cantidad de jarabe glucosado. Se encontraron diferencias
significativas para la glucosa obtenida entre los tres tratamientos
hidrolíticos. Los resultados demuestran que a partir de residuos
lignocelulósicos de la cáscara de banano maduro, se puede obtener bioetanol,
cuyo rendimiento obtenido de 7% v/v se aproxima a otros reportados en ese campo
de investigación. Por otro lado, el análisis de los costos variables del
pretratamiento aplicado a la cáscara de banano en la producción de etanol
obtenido permite estimar que el método planteado en este estudio es menos
costoso comparado con los demás, a partir del mismo residuo, con mayor
rendimiento de bioetanol e incluso en menor tiempo.
REFERENCIAS BIBLIOGRÁFICAS
[1] Abril, A. y Navarro, E. (2012).
Etanol a partir de biomasa lignocelulósica. Recuperado de
https://www.researchgate.net/profile/ Enrique_Navarro/publication/241216642_
Etanol_a_partir_de_biomasa_lignocelulosica/
links/0c96051c8409028b93000000/Etanol-apartir-de-biomasa-lignocelulosica.pdf
[2] Ávila, R., Rivas, B., Hernández, R.
y Chirinos, M. (2012). Contenido de azúcares totales, reductores y no
reductores en Agave cocui Trelease. Multiciencias,
12(2), 129-135.
[3] Benjamin, J., Singh, P., Dipuraj,
P., Singh, A., Rath, S., Kumar, Y., Masih, H. y Peter, J (2014). Bio-Ethanol production from banana peel by
simultaneous saccharification and fermentation process using cocultures
Aspergillus niger and Saccharomyces Recuperado de
https://www.researchgate.net/profile/
Yashab_Kumar/publication/307175371_BioEthanol_Production_from_Banana_peel_
by_Simultaneous_Saccharification_and_ Fermentation_Process_using_cocultures_
Aspergillus_niger_and_Saccharomyces_ cerevisiae/links/57dcf44b08ae5292a37c902b/
Bio-Ethanol-Production-from-Banana-peelby-Simultaneous-Saccharification-andFermentation-Process-using-coculturesAspergillus-niger-and-Saccharomyces-
cerevisiae.pdf
[4] Boluda, M., García, L., González,
F., y López, A. (2010). Mandarin peel wastes pretreatment with steam explosion
for bioethanol production. Bioresource
Technology, 101(10), 3506–3513.
[5] Canseco, M., Aráoz, J., Gusils, C. y
Zossi, S. (2015). Validación de metodología para determinación de azúcares
reductores totales en vinos fermentados. Revista
Industrial y Agrícola de Tucumán, 92(2), 33-38.
[1] Centeno, K. (2016). Efecto de la hidrólisis enzimática y la
pasteurización sobre la calidad de una bebida fermentada a base de maíz morado
(Zea mays) variedad Kulli. (Tesis de licenciatura). Universidad Nacional de
San Agustín de Arequipa, Arequipa.
Recuperado de http://repositorio.unsa.edu.
pe/bitstream/handle/UNSA/3294/IAceork02.pdf?sequence=1&isAllowed=y
[2] Conesa, C., Segui, L. y Fito, P.
(2013). Sacarificación de residuos
industriales de piña con mezclas de enzimas comerciales. Recuperado de
https://riunet. upv.es/bitstream/handle/10251/28121/
TESIS%20DE%20MASTER%20CLAUDIA.
pdf?sequence=1&isAllowed=y
[3] Jaramillo, O., Gómez, M. y Fontalvo,
J. (2012). Remoción de los inhibidores de la fermentación etanólica usando
membranas de polidimetilsiloxano (PDMS) por pervaporación. Revista ION, 25(1), 51-59.
[4] Ko, J., Um, Y., Park, Y., Seo, J. y
Kim, K. (2015). Compounds inhibiting the bioconversion of hydrothermally
pretreated lignocellulose. Applied
Microbiology and Biotechnology, 99(10), 4201–4212.
[5] Morales, M. (2012). Estrategia para la reconversión de una
industria integrada de azúcar y derivados para la producción de etanol y coproductos
a partir del bagazo (Tesis doctoral). Universidad Central “Marta Abreu” de
Las Villas, Santa Clara. Recuperado de http://dspace.uclv.edu.cu/
bitstream/handle/123456789/6707/Marlen%20
Morales%20Zamora%2C%202012.pdf?sequence=1&isAllowed=y
[6] Quintero, L., Martínez, Y., Velasco,
J., Arévalo, A., Muñoz, Y. y Urbina, N. (2015). Evaluación de residuos de papa,
yuca y naranja para la producción de etanol en cultivo discontinuo utilizando
Saccharomyces cerevisiae. Revista ION,
28(1), 43-53.
[7] Romero, H., Ayala, H. y Lapo, B.
(2015). Efecto de tres pre-tratamientos de cáscara de banano para la obtención
de jarabe glucosado mediante hidrólisis enzimática. Avances en Química, 10(1), 79-82.
[8] Saini, J., Saini, R., y Tewari, L.
(2015). Lignocellulosic agriculture wastes as biomass feedstocks for
second-generation bioethanol production: concepts and recent developments. 3 Biotech, 5(4), 337-353.
[9] Sánchez, A., Gutiérrez, A., Muñoz,
J. y Rivera, C. (2010). Producción de bioetanol a partir de subproductos
agroindustriales lignocelulósicos. Revista
Tumbaga, 1(5), 61-91.
[10] Saval, S. (2012). Aprovechamiento de
residuos agroindustriales: pasado, presente y futuro. BioTecnología, 16(2), 14-46.
[11] Silva, P. y Oliveira, S. de (2014).
Exergy analysis of pretreatment processes of bioethanol production based on
sugarcane bagasse. Energy, 76,
130-138.
[12] Sotelo, R., Avilez, R. y
Ginés-Carbajal, F. (2015). Obtención de bioetanol mediante la fermentación de
jarabes obtenidos de cáscara de naranja. Foro
de Estudios sobre Guerrero, 1(2), 589-591.
[13] Tejeda, A., López, Z., Rojas, D.,
Reyna, M., Barrera, A. y Zurita, F. (2015). Eficiencia de tres sistemas de
humedales híbridos para la remoción de carbamazepina. Tecnología y ciencias del agua, 6(6), 19-31.
[14] Thangavelu, S., Saleh, A. y Nasir, F.
(2016). Review on bioethanol as alternative fuel for spark ignition engines. Renewable and Sustainable Energy Reviews,
56, 820-835.
[15] Zhao, L., Cao, G., Wang, A., Guo,
W., Ren, H. y Ren, N. (2013). Simultaneous saccharification and fermentation of
fungal pretreated cornstalk for hydrogen production using Thermoanaerobacterium
thermosaccharolyticum W16. Bioresource
Technology, 145, 103-107.
Revista Industrial
Data 22(1): 187-202 (2019)
ISSN: 1560-9146 (Impreso) / ISSN: 1810-9993 (Electrónico)
DOI: http://dx.doi.org/10.15381/idata.v22i1.16534
Facultad de Ingeniería Industrial - UNMSM
Kinetic
study of bioethanol production from agroindustrial residues of ripe banana peel
Hugo Romero Bonilla [5]
Cinthia Macías Balón [6]
Aracelly Palacios Moreno [7]
Felipe Redrovan Pesantez [8]
Received: 15/01/2018 Accepted: 08/02/2019
|
ABSTRACT
This
research addresses the application of compound polyethylene glycol (PEG) of
molecular weight 1500, whose objective is to degrade the inhibiting compounds
present during the enzymatic hydrolysis of Cavendish variety ripe banana
peels. Likewise, three experiments were conducted on 60% ground banana peel,
to which PEG was added at different concentrations: 0.01; 0.02; and 0.03 g/g
biomass. The enzymatic hydrolysis was performed with conidia of the Trichoderma viride fungus and its
subsequent alcoholic fermentation with commercial active dry yeast Saccharomyces cerevisiae, which was
previously activated. The best result corresponds to the PEG3 experiment
(0.03 g/g biomass), with which a greater increase of reducing sugars was
obtained. In addition, significant differences were found (p<0.5) in the
glucose obtained among the three hydrolytic treatments. The results show that
bioethanol can be obtained from the lignocellulosic residues of ripe banana
peel, whose 7% v/v yield obtained is close to others reported in the same
field of study. Finally, the analysis of the variable costs of the
pretreatment, applied to the banana peel for the production of the ethanol
obtained, makes it possible to estimate that the method proposed in this
article is less expensive compared to other procedures, demonstrating a
higher bioethanol yield obtained in less time.
|
Keywords: Banana peel; polyethylene glycol; enzymatic hydrolysis; alcoholic
fermentation; bioethanol.
INTRODUCTION
The increasing demand of petroleum-derived
fuel, due to the rapid development of the automotive industry, together with
environmental contamination problems, have inspired the efforts in the
exploration of alternative fuels (Thangavelu, Saleh & Nasir, 2016). From
this perspective, the production and consumption of renewable, sustainable and
environmentally friendly energy has been fostered, through lignocellulosic
biomass, which can be obtained from waste materials from agricultural
activities (Conesa, Segui & Fito, 2013). Biofuel sources are geographically
distributed more evenly than fossil fuels, which make them an ideal option to
meet needs in a sustainable manner. Several promoters of this energy
alternative underline the increasing interest in biofuels, due to the growing
uncertainty of petroleum supplies as a result of increases in demand, the
decline in known reserves, the concern over global warming and greenhouse gas
emissions associated with the use of fossil fuels (Saini, Saini & Tewari,
2015).
Plant substrates are composed of
cellulose, hemicellulose and lignin, which were considered the raw material of
the future for the production of biofuels due to their low cost and
availability (Abril & Navarro, 2012). The production and use of these fuels
help to minimize greenhouse gas emissions, since they are obtained from
alternative energy sources. Likewise, the production of bioethanol from
lignocellulosic matter involves different stages: pretreatment, hydrolysis,
fermentation (Silva & Oliveira, 2014).
For these
reasons, this study will use banana peel, which is an abundant source of
cellulosic material. It is the external component of the banana, representing
about 40% of its weight and having the potential to produce alcohol. However,
chemical and biochemical processing is necessary to convert these polymers into
monomeric sugars (Quintero, Martínez, Velasco et al., 2015). Once in monomeric form, the sugars can be converted
by fermentative microorganisms into bioethanol. However, undesir-
able compounds are produced during pretreatment
and hydrolysis, which negatively affect the yeast fermentation rate. Also, the
toxicity of these compounds (called inhibitors) on microorganisms is one of the
main limiting factors in the bioethanol yield during fermentation (Jaramillo,
Gómez & Fontalvo, 2012). Therefore, a pretreatment must be carried out before
hydrolysis in order to remove lignin, hydrolyze hemicellulose to fermentable
sugars, and reduce the crystallinity of the cellulose to release glucose
(Morales, 2012). This determines the yield that would be obtained after
alcoholic fermentation.
In this sense, Saval (2012) states that
enzymatic hydrolysis should be applied once the waste has been treated. In this
way, the polymer chains are more exposed so that the generation of toxic
compounds does not increase and the addition of chemical compounds is avoided.
The process is carried out by the addition of cellulitic enzymes to the
bioreactor (Zhao, Cao, Wang et al.,
2013). Trichoderma is used in the
biotechnology industry due to its ability to produce various metabolites and
its adaptation to various environmental conditions and substrates. On the other
hand, the Saccharomyces cerevisiae yeast is frequently used in alcoholic
fermentation (Sotelo, Avilez & Ginés-Carbajal, 2015), as it is a
facultative anaerobic microorganism that has the ability to ferment glucose and
does not present many nutrient demands. For this reason, the objective of this
investigation was to hydrolyze the cellulose and hemicellulose present in ripe
banana peel to reducing sugars and its subsequent alcoholic fermentation to
obtain second-generation bioethanol.
METHODOLOGY
Materials
The ripe banana peels used belong to the
Cavendish variety. These had been discarded from the production lines of the
company Diana Food S. A., which has its processing plant in Pasaje, El Oro
province, Ecuador. Likewise, Sigma-Aldrich's (Germany) polyethylene glycol with
molecular weight 1500 (PEG 1500) was used. The fungus was obtained from
Trichoeb, provided by Ecua Biológica (Ecuador) and dry active yeast was
provided by Levapan (Ecuador).
Pretreatments
The peel was ground in order to
increase its contact area with the fungus, then a heat treatment was carried
out in an All American 25X sterilizer at 121°C for 15 minutes.
Experiment design
Three solutions of 60% ground banana peel were prepared;
being a concentration reported by Romero, Ayala, and Lapo (2015) since this
percentage of peels allows a higher concentration of hydrolyzed glucose. In
order to evaluate its effect as an inhibitor in hydrolysis - since lignin and
other compounds present in the lignocellulosic residues limit the hydrolysis of
cellulose and hemicellulose (Ko, Um, Park et
al., 2015) – three different concentrations of PEG 1500, shown in Table 1,
were added: PEG1 (0.01) ; PEG2 (0.02) and PEG3 (0.03 g/g biomass ).
Table 1. Factors and
levels of the experiment.
|
Adsorbents
|
PEG concentration (g PEG/g biomass)
|
|
|
|
|
|
|
[ ]1
|
[ ]2
|
[ ]3
|
|
PEG 1500
|
0.01
|
0.02
|
0.03
|
[ ]1: Concentration 1; [ ]2: Concentration 2; [ ]3 : Concentration
3 Source: Prepared by the authors.
Enzymatic hydrolysis
The enzymatic hydrolysis of the biomass was
carried out in 2L bioreactors at 60% peel concentration, to which three
different concentrations of PEG 1500 (0.01-0.03 g PEG/g biomass) were added.
These had been dissolved in purified water and shaken for 5 minutes for the PEG
to absorb the enzymatic hydrolysis inhibitors. Subsequently, 0.4 g/L of conidia
from the Trichoderma viride fungus
were added. It was shaken for 24 hours at 200 rpm and a sample was taken every
hour. During the process, pH, °Bx (Brix degrees) and dissolved oxygen were
measured, for which a portable meter was used according to the method
demonstrated by Tejeda, López, Rojas et
al. (2015).
Quantification of reducing sugars
For the glucose quantification, a
hydrolyzate sample was taken in a test tube and centrifuged at 10,000 rpm for
10 min, and a 1:10 dilution was made with the supernatant. Then, 0.5 mL of the
dilution and 0.5 mL of the DNS reagent were taken and placed in a test tube in
a water bath at 100 °C for 5 min. In this period, 3.5 dinitrosalicylic acid was
reduced by the reducing sugars that came in contact with it, causing a change
in color with variations from yellow to coffee-colored (Ávila, Rivas, Hernández
et al., 2012). It was cooled to room
temperature and 5 mL of distilled water was added. It was shaken and the
reading was made at 540 nm in the Hach DR 3900 spectrophotometer (Canseco,
Aráoz, Gusils et al., 2015).
Experiment PEG3 (PEG 0.03 g/g husk), which was
the treatment with the highest concentration of glucose, was used to perform
fermentation to obtain bioethanol.
Fermentation
After the enzymatic hydrolysis of the peel, the
fungus was inactivated by pasteurizing it at 90 °C for 10 min (Centeno, 2016).
A volume of 1000 mL was used, the pH was controlled and 800 cfu/mL of
commercial dry yeast (Saccharomyces
cerevisiae) that was previously activated was added. Also, the glucose
syrup was placed in an anaerobic bioreactor, where samples were taken to
measure the alcohol concentration using gas chromatography. The pH, °Bx and
dissolved oxygen were measured with multiparameter equipment.
Comparative estimation of
variable costs
A comparative estimation of variable
costs of the saccharification process by enzymatic hydrolysis and alcoholic
fermentation was conducted, for which a calculation basis of 600g of peel/L
solution was assumed.
Table 2 details the costs of the supplies
needed in the process:
Table 2. Estimated
cost of the necessary supplies for the saccharification process by enzymatic hydrolysis
and alcoholic fermentation from ripe banana peel.
|
Dependent variable: cost
|
|
Supplies
|
Cost
|
|
Trichoderma (inoculum for hydrolysis in this study)
|
$ 0.05 per 600g of peel
|
|
Polyethylene glycol
(process proposed in this study)
|
$ 2.52 per 600 g of peel
|
|
Steam for pasteurization
(process proposed in this study)
|
$ 0.25 per kg of water
vapor
|
|
Ethanol for the
disinfection of the peel (process proposed in literature)
|
$ 0.70 per 600 g of peel
|
|
Asperguillus (inoculum for hydrolysis proposed in the
literature)
|
$ 0.01 per 600 g of peel
|
|
Saccharomyces
|
$ 12.00 per 600 g
|
|
Banana peel and transport
|
$ 0.072
|
Source:
Prepared by the authors.
RESULTS
Figure 1 presents the production of reducing sugars
(mg/L) after the 3 treatments and a control sample during 24 hours of enzymatic
hydrolysis.
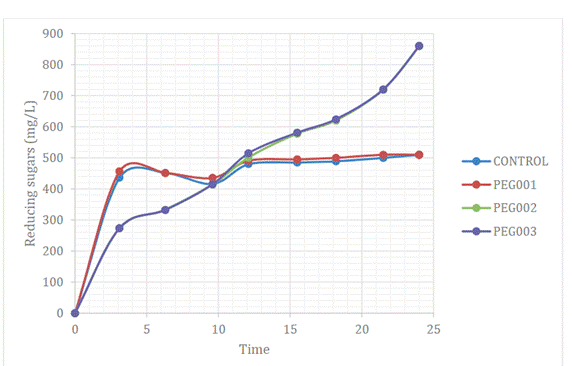
Figure 1. Kinetics of enzymatic hydrolysis
for the treatments during 24 hours
Source: Prepared by the authors
In the experiment with PEG 0.03 g/g biomass reducing
sugars increased by 895.95 (± 1.9) mg/L, a significant difference with respect
to the other treatments, as can be seen in the Table 3, where all the p-values
reached values less than 0.05.
|
Table 3. Variance analysis of glucose production based on the pretreatments
applied to ripe banana peel.
|
Dependent variable: glucose
|
|
|
|
Origin
|
Type III sum of squares
|
df
|
Mean square
|
F
|
Sig.
|
|
Model
reviewed
|
1
295,110.438a
|
31
|
41
777.756
|
2413.156
|
0.000
|
|
Intersection
|
18 604
125.563
|
1
|
18 604
125.563
|
1 074
606.531
|
0.000
|
|
Time
|
788
371.938
|
7
|
112
24.563
|
6505.390
|
0.000
|
|
PEGC
|
99
025.312
|
3
|
33
008.437
|
1906.625
|
0.000
|
|
Time *
PEGC
|
407
713.187
|
21
|
19
414.914
|
1121.439
|
0.000
|
|
Error
|
554.000
|
32
|
17.313
|
|
|
|
Total
|
19 899
790.000
|
64
|
|
|
|
|
Total
reviewed
|
1 295
664.438
|
63
|
|
|
|
|
a. R
squared = 1000 (adjusted R-squared =
0.999)
|
|
|
|
Source:
Prepared by the authors.
Moreover, Figure 2 shows the effect of
polyethylene glycol (PEG) added to the ground ripe banana peel at different concentrations
(Table 1) in the production of glucose. It can be observed that there are
significant differences between the pretreatments studied.
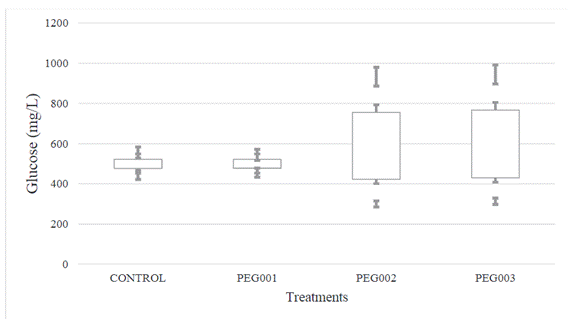
Figure 2. Average changes of glucose according
to the pretreatments applied to the ripe banana peel (95% confidence).
Source: Prepared by the authors.
In turn, the variation of pH with respect to
the time of enzymatic hydrolysis of ripe banana peel under the study conditions
can be observed in Figure 3.
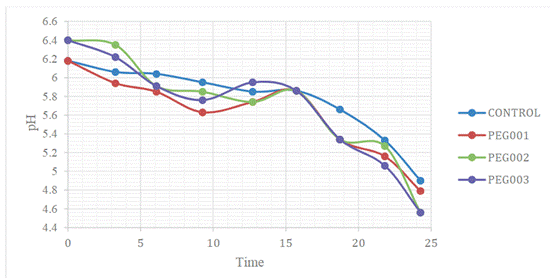
Figure 3. Variation of pH with respect to
the time of hydrolysis at a scale of 2 L.
Source: Prepared by the authors.
Also, the decrease in dissolved oxygen during
the hydrolysis process is shown in Figure 4.
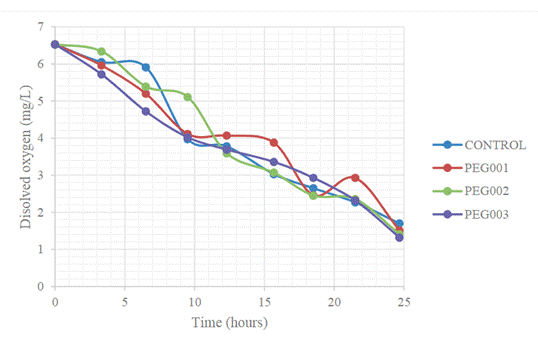
Figure 4. Decrease in dissolved oxygen of
enzymatic hydrolysis at a scale of 2 L
Source: Prepared by the authors.
Additionally, the behavior of bioethanol
production during fermentation for a period of 4 days is observed in Figure 5.
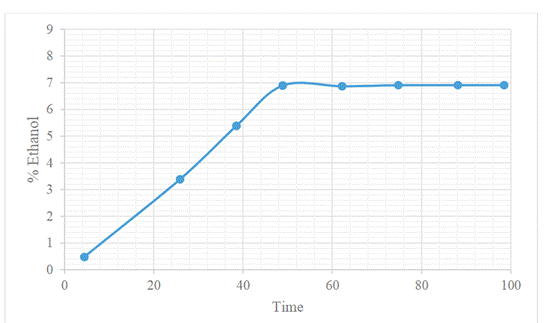
Figure 5. Kinetics of bioethanol production
during alcoholic fermentation.
Source: Prepared by the authors.
DISCUSSION
Figure 1 shows that the addition of
PEG with 0.02 and 0.03 g/g biomass concentration (PEG2 and PEG3) increases the
production of reducing sugars up to 895.95 (± 1.9) mg/L, which made it possible
to achieve an alcohol yield of 7% v/v (Figure 5). The yield of ethanol obtained
in this study is greater than that reported by Benjamin, Singh, Dipuraj et al. (2014), who found 2.38% and 6%
ethanol at 2 and 7 days, respectively. These authors used 5% ground peel, Aspergillus niger at 3% w/v and pH 6,
and disinfected the banana peel with 70% ethanol. Subsequently, it was dried in
the sun for 7 days and fermented with 4% v/v of Saccharomyces cerevisiae
inoculum.
A comparative study of variable
costs can be observed in Table 3. Higher ethanol yields (59.3% w/v) have been
reported by Boluda, García, González et
al. (2010) from tangerine peel, but using steam explosion as pretreatment
of the biomass used in alcoholic fermentation. Precisely, this pretreatment has
the disadvantage of causing the generation of inhibitors that affect the
fermentation process, so it must be combined H2SO4 or CO2 to improve the efficiency of the
process; in addition, there is a risk of producing of soluble phenolic
compounds (Sánchez, Gutiérrez, Muñoz et
al., 2010).
On the other hand, with respect to
the decrease in pH during the hydrolysis time of the ripe banana peel in the
PEG1, PEG2 and PEG3 treatments (Figure 3), it can be shown that this is
produced from 6.2 to 4.9 pH units in the control treatment; from 6.2 to 4.8 in
the PEG1 treatment; from 6.5 to 4.6 in the PEG2 treatment; and from 6.5 to 4.6
in the PEG3 treatment; and it is stabilized after 18 hours of hydrolysis in all
treatments, which indicates that the fungus modifies the pH of the culture
medium for its growth and glucose production.
Regarding the behavior of dissolved
oxygen with respect to time (Figure 4), a decrease can be observed as enzymatic
hydrolysis progresses, since a percentage of this microorganism consumes
dissolved oxygen as part of the aerobic metabolic pathway.
In addition, the analysis of the
variable costs of the pretreatment applied to banana peel in the production of the
ethanol obtained in this study, regarding the glucose produced from the best
applied treatment (PEG3) and compared with other studies, is presented in Table
4:
Table 4. Comparison of variable costs in
dollars for the process of obtaining ethanol from the enzymatic hydrolysis of
ripe banana peel (600 g).
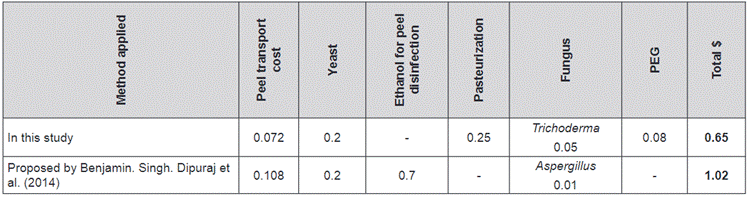
Source: Prepared by the authors.
These costs are calculated in
dollars for each stage of the process used, both in enzymatic hydrolysis and in
alcoholic fermentation, using a calculation basis of 600 g of ripe banana peel
(60% w/v).
It is important to mention that the
method mentioned by Benjamin, Singh, Dipurak et al. (2014) includes a 7-day banana peel drying stage, which is
an important disadvantage for the process proposed by these authors.
CONCLUSIONS
It was observed that polyethylene glycol (PEG)
influences the conversion of the ripe banana peel cellulose into glucose by
enzymatic hydrolysis. PEG3 was the treatment that produced the highest amount
of glucosed syrup. Significant differences were found in the glucose obtained
between the three hydrolytic treatments. The results show that bioethanol can
be obtained from lignocellulosic waste of ripe banana peel, whose 7% v/v yield
obtained is close to others reported in this field of research. On the other
hand, the analysis of the variable costs of the pretreatment applied to the
banana peel in the production of ethanol obtained make it possible to estimate
that the method proposed in this study is less expensive compared to others,
uses the same residues, and produces a higher yield of bioethanol in even in
less time.
REFERENCES
[1]
Abril, A. & Navarro, E. (2012). Etanol a partir de biomasa lignocelulósica.
Retrieved from https://www.researchgate.net/profile/
Enrique_Navarro/publication/241216642_
Etanol_a_partir_de_biomasa_lignocelulosica/
links/0c96051c8409028b93000000/Etanol-apartir-de-biomasa-lignocelulosica.pdf
[2]
Ávila, R., Rivas, B., Hernández, R.
& Chirinos, M. (2012). Contenido de azúcares totales, reductores y no
reductores en Agave cocui Trelease. Multiciencias,
12(2), 129-135.
[3]
Benjamin, J., Singh, P., Dipuraj, P.,
Singh, A., Rath, S., Kumar, Y., Masih, H. & Peter, J (2014). Bio-Ethanol production from banana peel by
simultaneous saccharification and fermentation process using cocultures Aspergillus
niger and Saccharomyces. Retrieved from
https://www.researchgate.net/profile/
Yashab_Kumar/publication/307175371_BioEthanol_Production_from_Banana_peel_
by_Simultaneous_Saccharification_and_ Fermentation_Process_using_cocultures_
Aspergillus_niger_and_Saccharomyces_ cerevisiae/links/57dcf44b08ae5292a37c902b/
Bio-Ethanol-Production-from-Banana-peelby-Simultaneous-Saccharification-andFermentation-Process-using-coculturesAspergillus-niger-and-Saccharomyces-
cerevisiae.pdf
[4]
Boluda, M., García, L., González, F.,
& López, A. (2010). Mandarin peel wastes pretreatment with steam explosion
for bioethanol production. Bioresource
Technology, 101(10), 3506–3513.
[5]
Canseco, M., Aráoz, J., Gusils, C.
& Zossi, S. (2015). Validación de metodología para determinación de
azúcares reductores totales en vinos fermentados. Revista Industrial y Agrícola de Tucumán, 92(2), 33-38.
[6]
Centeno, K. (2016). Efecto de la hidrólisis enzimática y la pasteurización sobre la
calidad de una bebida fermentada a base de maíz morado (Zea mays) variedad
Kulli. (Bachelor thesis). Universidad Nacional
de San Agustín de Arequipa, Arequipa. Retrieved from http://repositorio.unsa.edu.
pe/bitstream/handle/UNSA/3294/IAceork02.pdf?sequence=1&isAllowed=y
[7]
Conesa, C., Segui, L. & Fito, P.
(2013). Sacarificación de residuos
industriales de piña con mezclas de enzimas comerciales. Retrieved from
https://riunet. upv.es/bitstream/handle/10251/28121/
TESIS%20DE%20MASTER%20CLAUDIA.
pdf?sequence=1&isAllowed=y
[8]
Jaramillo, O., Gómez, M. &
Fontalvo, J. (2012). Remoción de los inhibidores de la fermentación etanólica
usando membranas de polidimetilsiloxano (PDMS) por pervaporación. Revista ION, 25(1), 51-59.
[9]
Ko, J., Um, Y., Park, Y., Seo, J.
& Kim, K. (2015). Compounds inhibiting the bioconversion of hydrothermally
pretreated lignocellulose. Applied
Microbiology and Biotechnology, 99(10), 4201–4212.
[10] Morales, M. (2012). Estrategia
para la reconversión de una industria integrada de azúcar y derivados para la
producción de etanol y coproductos a partir del bagazo (Doctoral thesis).
Universidad Central “Marta Abreu” de Las Villas, Santa Clara. Retrieved from
http://dspace.uclv.edu.cu/
bitstream/handle/123456789/6707/Marlen%20Morales%20Zamora%2C%202012.pdf?sequence=1&isAllowed=y
[11] Quintero, L., Martínez, Y., Velasco, J., Arévalo, A., Muñoz, Y. &
Urbina, N. (2015). Evaluación de residuos de papa, yuca y naranja para la
producción de etanol en cultivo discontinuo utilizando Saccharomyces
cerevisiae. Revista ION, 28(1),
43-53.
[12] Romero, H., Ayala, H. & Lapo, B. (2015). Efecto de tres
pre-tratamientos de cáscara de banano para la obtención de jarabe glucosado
mediante hidrólisis enzimática. Avances
en Química, 10(1), 79-82.
[13] Saini, J., Saini, R., & Tewari, L. (2015). Lignocellulosic
agriculture wastes as biomass feedstocks for second-generation bioethanol
production: concepts and recent developments. 3 Biotech, 5(4), 337-353.
[14] Sánchez, A., Gutiérrez, A., Muñoz, J. & Rivera, C. (2010).
Producción de bioetanol a partir de subproductos agroindustriales lignocelulósicos.
Revista Tumbaga, 1(5), 61-91.
[15] Saval, S. (2012). Aprovechamiento de residuos agroindustriales: pasado,
presente y futuro. BioTecnología,
16(2), 14-46.
[16] Silva, P. & Oliveira, S. de (2014). Exergy analysis of pretreatment
processes of bioethanol production based on sugarcane bagasse. Energy, 76, 130-138.
[17] Sotelo, R., Avilez, R. & Ginés-Carbajal, F. (2015). Obtención de
bioetanol mediante la fermentación de jarabes obtenidos de cáscara de naranja. Foro de Estudios sobre Guerrero, 1(2),
589-591.
[18] Tejeda, A., López, Z., Rojas, D., Reyna, M., Barrera, A. & Zurita,
F. (2015). Eficiencia de tres sistemas de humedales híbridos para la remoción
de carbamazepina. Tecnología y ciencias
del agua, 6(6), 19-31.
[19] Thangavelu, S., Saleh, A. & Nasir, F. (2016). Review on bioethanol
as alternative fuel for spark ignition engines. Renewable and Sustainable
Energy Reviews, 56, 820-835.
[20] Zhao, L., Cao, G., Wang, A., Guo, W., Ren, H. & Ren, N. (2013).
Simultaneous saccharification and fermentation of fungal pretreated cornstalk
for hydrogen production using Thermoanaerobacterium thermosaccharolyticum W16. Bioresource Technology, 145, 103-107.











